Für die Impfung von Kindern unter 5 Jahren bittet Pfizer die FDA um grünes Licht
Die Verabreichung in der Altersgruppe von 6 Monaten bis 5 Jahren, erwartet ein Zehntel der Dosis bei Erwachsenen
Per restare aggiornato entra nel nostro canale Whatsapp
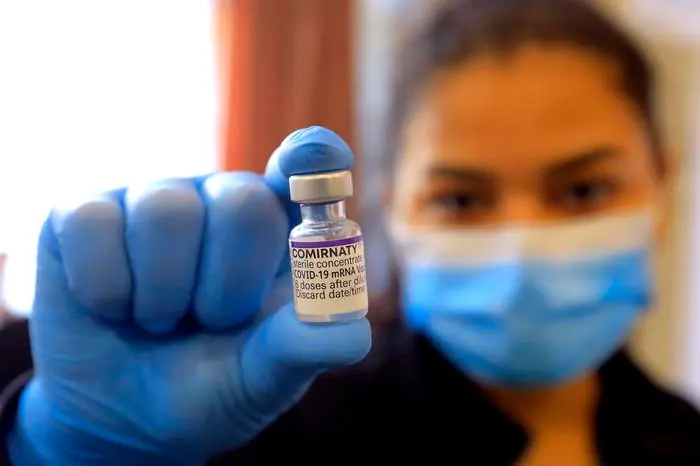
Pfizer hat bekannt gegeben, dass es bei der Food and Drug Administration (FDA) eine Notfallgenehmigung für seinen Covid-19-Impfstoff für Kinder im Alter von 6 Monaten bis 5 Jahren beantragt hat. Im Falle einer Zulassung wäre es der erste Impfstoff in den Vereinigten Staaten für diese Altersgruppe.
Der Impfstoff könnte in den USA bereits Ende Februar oder Anfang März zur Verabreichung verfügbar sein.
Und gerade bei Kindern von null bis fünf Jahren haben die Krankenhausaufenthalte im Bereich Medizin und Wiederbelebung in Italien in den letzten vier Wochen zugenommen, so die gestern vom Verband der italienischen Kinderkrankenhäuser (Aopi) bereitgestellten Daten, die das neu starten Einladung an die Eltern zur Impfung zum Schutz der Kleinen und zur Impfung von Kindern zwischen 5 und 11 Jahren, für die das Präparat bereits von der Europäischen Arzneimittelagentur (EMA) und der italienischen AIFA zugelassen wurde.
Der jetzt der FDA vorgelegte Pfizer-Impfstoff wird ebenfalls dem gleichen Verfahren folgen und, wenn er von der US-Behörde genehmigt wird, dann den EMA-Wissenschaftlern und der italienischen Aufsichtsbehörde vorgelegt.
WIE ES FUNKTIONIERT - Für das Präparat für Kinder von sechs Monaten bis fünf Jahren wurde bekannt, dass eine Dosis von einem Zehntel der für Erwachsene verwendeten Dosis verwendet wird und der Zyklus anfänglich zwei Impfungen umfasst. In der Zwischenzeit wird das Pharmaunternehmen die Wirksamkeit von drei Dosen desselben Impfstoffs weiter untersuchen, da laut einer Quelle gegenüber der Washington Post nur zwei Dosen keine ausreichende Immunantwort ausgelöst hätten.
"Wir wissen, dass zwei Dosen nicht ausreichen - sagte die Quelle - aber die Idee ist, mit der Analyse der Daten über die Verwendung von zwei Dosen zu beginnen und auf die Ergebnisse der Tests zur dritten Dosis zu warten, die voraussichtlich Ende März eintreffen. ".
(Unioneonline / vl)